本帖最后由 小屋自习室 于 2019-11-21 17:26 编辑

在知乎看到过这样一个问题:
想了解一种疾病,除了通过书籍还有别的途径了解吗,专业方面的,不要像百度这一种的,谢谢?
很赞同多位答主提到的了解方法,那就是:看指南。
对指南,Google 是这样解释的:

在现代循证医学的时代,很多疾病都有标准化的最优治疗方案。而指南,就是由相关学术组织系统制定出的帮助临床医生做出恰当处理的指导意见,就好像被誉为每个肿瘤科医生必备圣经的「 NCCN 指南 」,日常工作中需要经常翻阅。
关于白血病的基础知识科普,小屋正在陆续整理完善,相信应该能够解决很多新病友的大部分疑问,同时也打算来次知识升级,抽空整理一些白血病的相关指南和专家共识。要知道,指南不单对医生,对学习能力强的患者或家属也有“指导”作用,指导你们更有针对性、更顺畅的和医护人员沟通。
大家在平时的治疗过程中习惯了「 听医生的 」,并不知道在整个疾病诊疗领域有什么主流的观点和意见。所以,通过当前最佳医学证据的临床实践指南面向咱们病友群体进行科普宣传,应该也是可以尝试的吧?
目前就很多疾病的诊疗指南来说,中国很少参与或独立制定国际标准,大多数临床指南都是照搬或模仿国外的。但白血病方面,中国真的是不差的,中国有丰富的病例资源和大量的临床数据,完全可以制定出更多的中国版临床指南的,所以今天自习室整理的是摘自《中华血液学杂志》的 :
中国成人急性淋巴细胞白血病诊断与治疗指南( 2016 年版)
中国抗癌协会血液肿瘤专业委员会、中华医学会血液学分会白血病淋巴瘤学组
成人急性淋巴细胞白血病(ALL)是最常见的成人急性白血病之一,约占成人急性白血病的 20%~ 30% ,目前国际上有比较统一的诊断标准和不同研究组报道的系统治疗方案,完全缓解(CR)率可达 70%~90% ,3~5 年无病生存(DFS)率达 30%~60% ;美国癌症综合网(NCCN)于 2012 年首次公布了 ALL 的诊断治疗指南,我国于 2012 年发表我国第 1 版成人 ALL 诊断与治疗的专家共识,得到了国内同行的认可。
最近 2016 版 WHO 造血与淋巴组织肿瘤分类发表,对于 ALL 的分类有一些更新,提出了一些新概念;NCCN 对于成人 ALL 的临床指南也先后几次修改。
基于此,对我国成人 ALL 诊断与治疗的专家共识进行了更新。
一、诊断分型
(一) 概述
ALL 诊断应采用 MICM (形态学、免疫学、细胞遗传学和分子学)诊断模式,诊断分型采用 WHO 2016 标准。最低标准应进行细胞形态学、免疫表型检查,以保证诊断的可靠性;骨髓中原始/幼稚淋巴细胞比例 ≥20% 才可以诊断 ALL ;免疫分型应采用多参数流式细胞术,最低诊断分型可以参考 1995 年欧洲白血病免疫学分型协作组(EGIL)标准(表 1 ),疾病分型参照 WHO 2016 版分类标准。
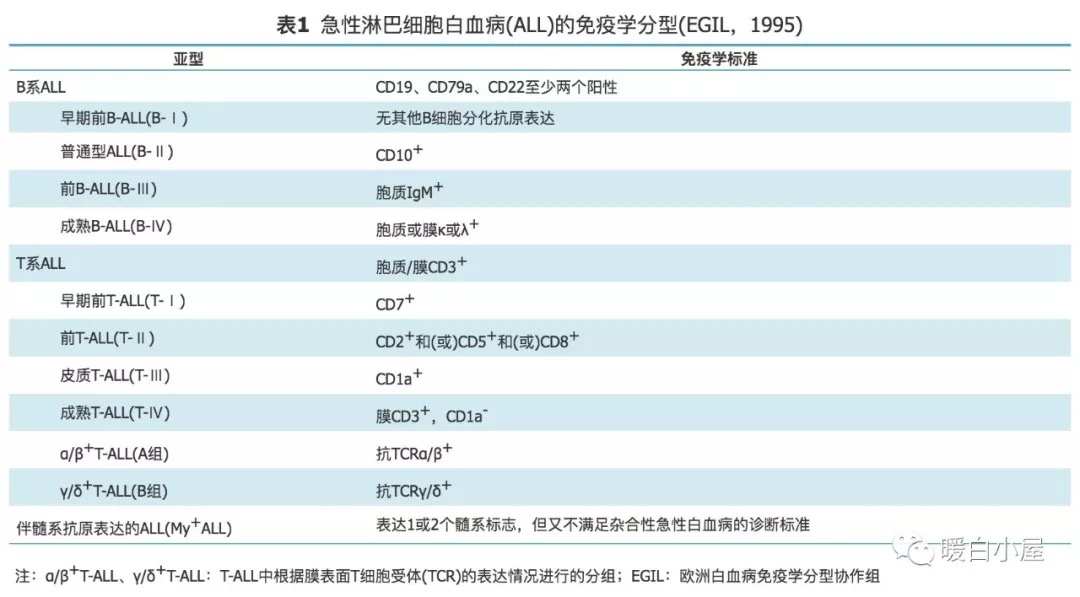
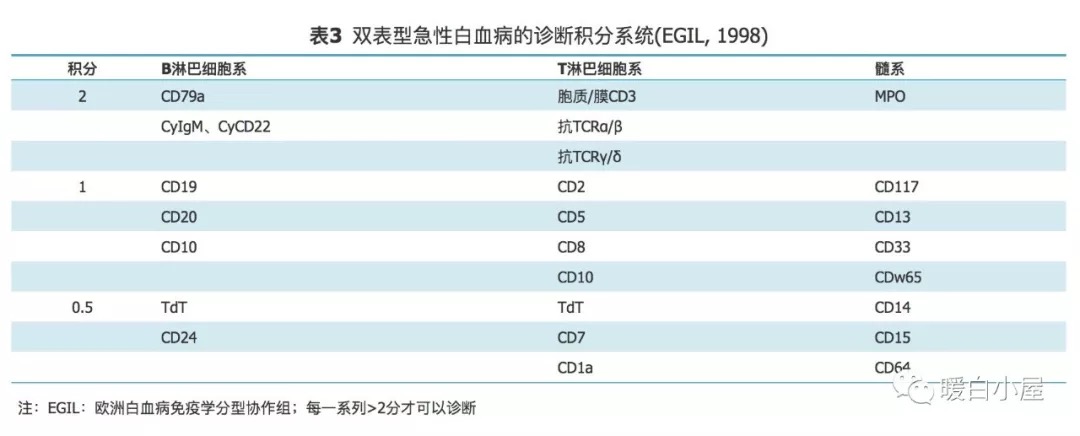
同时应除外混合表型急性白血病,混合表型急性白血病的系列确定建议参照WHO 2008造血及淋巴组织肿瘤分类的标准(表 2 ),可以同时参考 1998 EGIL标准(表 3 )。

预后分组参考 Gökbuget 等发表的危险度分组标准(表 4 )。
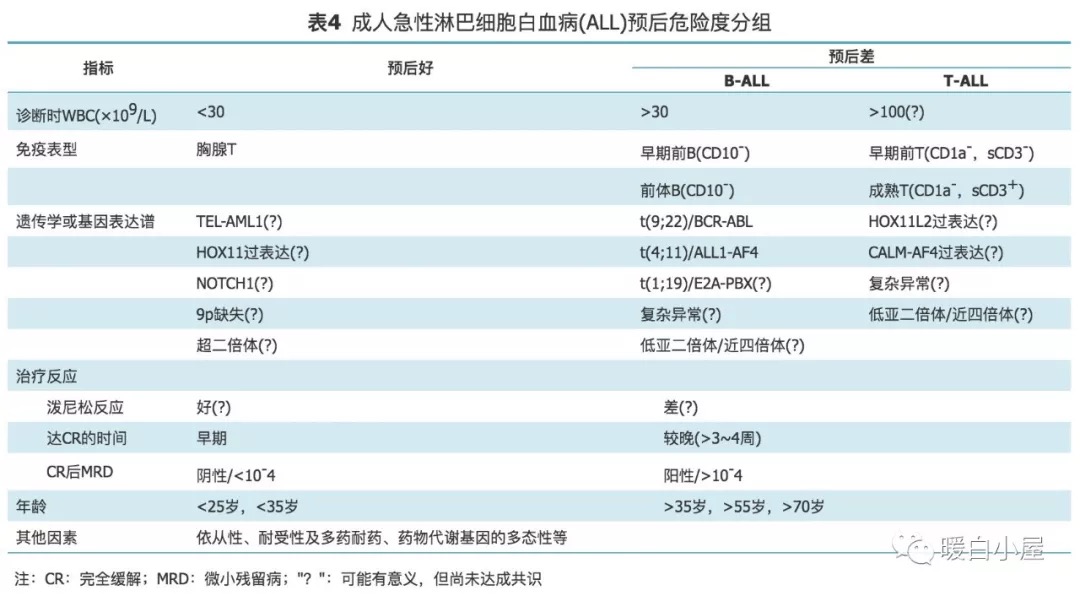
细胞遗传学分组参考 NCCN 2016 建议:预后良好遗传学异常包括超二倍体( 51~65 条染色体)、t(12;21)(p13;q22)和(或) ETV6-RUNX1 ;预后不良遗传学异常包括亚二倍体(<44条染色体)、t(v;11q23) [t(4;11)和其他 MLL 重排]、t(9;22)(q34; q11.2)、复杂染色体异常。
建议开展相关的遗传学检查,提供诊断分型、预后判断所需的标志,如:IKZF1缺失、CDKN2A/B 缺失、CRLF2 重排、JAK2 重排、NOTCH1 突变等(有条件者可以行 ABL1、ABL2 基因分离探针的分析)。
ALL 诊断确立后应根据具体分型、预后分组采用规范化的分层治疗策略,以取得最佳治疗效果。
(二) WHO 2016 版前体淋巴细胞肿瘤分类
1.原始 B 淋巴细胞白血病/淋巴瘤:
具体见表 5 。

2.原始 T 淋巴细胞白血病/淋巴瘤:
根据抗原表达可以划分为不同的阶段:早期前 T、前 T、皮质 T、髓质 T。建议分类:早期前体T淋巴细胞白血病(Early T-cell precursor lymphoblastic leukemia,ETP)。
(三) 几种特殊类型 ALL 的特点
1.BCR-ABL1 样 ALL(BCR-ABL1-like ALL):
(1) 和 BCR-ABL1 阳性 ALL 患者具有相似的基因表达谱。
(2) 共同特征是涉及其他酪氨酸激酶的易位、CRLF2 易位。还包括 EPO 受体(EPOR)截短重排、激活等少见情况。CRLF2 易位患者常与 JAK 基因突变有关。
(3) 涉及酪氨酸激酶突变的易位可以累及 ABL1 (伙伴基因并非 BCR )、ABL2 、PDGFRB、NTRK3、TYK2、CSF1R、JAK2 等,形成 30 余种伴侣基因。
(4) IKZF1 和 CDKN2A/B 缺失发生率较高。
2.伴21号染色体内部扩增的 B-ALL(with intrachromosomal amplification of chromosome 21, iAMP21):
(1) 第 21 号染色体部分扩增(采用 RUNX1 探针,FISH 方法可发现 5 个或 5 个以上的基因拷贝,或中期分裂细胞的一条染色体上有 ≥3 拷贝)。
(2) 占儿童 ALL 的 2% ,成人少见。
(3) 低白细胞计数。
(4) 预后差,建议强化疗。
3.ETP-ALL:
(1) CD7 阳性,CD1a 和 CD8 阴性。CD2、胞质 CD3 阳性,CD4 可以阳性。
(2) CD5 一般阴性,或阳性率 <75% 。
(3) 髓系/干细胞抗原 CD34 、CD117、HLA-DR、CD13、CD33、CD11b 或CD65 一个或多个阳性。
(4) 常伴有髓系相关基因突变:FLT3、NRAS/KRAS、DNMT3A、IDH1 和IDH2 等。
(5) T-ALL 常见的突变,如 NOTCH1、CDKN1/2 不常见。
(四) Burkitt 淋巴瘤/白血病(BL)的诊断
尽管 WHO 造血及淋巴组织肿瘤分类将 BL 归入成熟 B 细胞肿瘤,但由于该疾病的高度侵袭性、多以骨髓受累起病、治疗较为特殊的特点,仍然将该疾病纳入本指南讨论。
1.细胞形态学:
① 典型 BL ;
② 变异型——浆细胞样 BL 和不典型 Burkitt/Burkitt 样。
2.免疫表型:
细胞表达轻链限制性膜 IgM 和 B 细胞相关抗原 CD19 、CD20 、CD22 及CD10 、Bcl-6 。CD5 、CD23 、TdT 阴性,Bcl-2 阴性。浆细胞样变异型细胞内可检测到单一的胞质内免疫球蛋白,几乎 100% 的细胞 Ki-67 阳性。
3.遗传学:
肿瘤细胞的免疫球蛋白重链和轻链基因为克隆性重排,所有患者均有 t(8;14)(q24; q32)/MYC-IgH改变或较少见的t(2;8)(p12;q24)/Igκ-MYC或t(8;22)(q24;q11)/MYC-Igλ 。
根据 WHO 2016 淋巴肿瘤分类建议,怀疑 BL 者注意查 TCF3 和 ID3 突变(发生率可达 70% )。注意与"伴 11q 异常的 Burkitt 样淋巴瘤"鉴别(一种新的建议分类,形态学类似 BL ,但无 MYC 基因重排;伴有 11q 改变。和 BL 比较更易出现复杂染色体异常、MYC 低表达、细胞形态多形性,偶尔可类似滤泡类型,常常呈结节改变)。
BL 的预后不良因素包括:年龄偏大、疾病晚期( Ⅲ 期以上)、体能状况差、骨髓受累(尤其是外周血出现原始细胞)或中枢神经系统(CNS)受累、LDH 增高等。
二、治疗
患者一经确诊后应尽快开始治疗,治疗应根据疾病分型采用合适的治疗方案、策略。
以下患者予以预治疗,以防止肿瘤溶解综合征的发生:确诊 BL 的患者;ALL( Ph 阴性或 Ph 阳性)患者,若 WBC≥50×10^9/L,或者肝、脾、淋巴结肿大明显,或有发生肿瘤溶解特征。预治疗方案:糖皮质激素(如泼尼松、地塞米松等)口服或静脉给药,连续 3~5 d 。可以和环磷酰胺(CTX)联合应用( 200 mg·m-2·d-1,静脉滴注,连续 3~5 d )。
(一) BL 的治疗
1.由于该类型患者肿瘤细胞增殖速度快,治疗方案建议优先采用短疗程、短间隔的治疗。治疗疗程一般不少于 6 个,如 MDACC 的 Hyper-CVAD 、大剂量甲氨蝶呤(HD-MTX)+大剂量阿糖胞苷(HDAra-C)方案;GMALL 方案(A、B方案)。鉴于抗 CD20 的单克隆抗体(利妥昔单抗)可以明显改善此类患者的预后,有条件的患者可联合抗 CD20 的单克隆抗体治疗。
2.治疗中应注意早期开始、充分的中枢神经系统白血病(CNSL)预防和治疗,包括鞘内注射化疗药物和头颅放疗的进行。
3.考虑预后不良的患者推荐进行造血干细胞移植:有合适供者的患者可以行异基因造血干细胞移植(allo-HSCT),无供者的患者可以考虑自体造血干细胞移植(AHSCT)。
推荐方案:
1.GMALL B-NHL86(A、B方案)方案(Hoffmann C. Leuk & Lymphoma, 2006, 47: 1872-1880. Oriol A. Cancer, 2008, 113:117-125) ± 利妥昔单抗。
2.Hyper-CVAD ± 利妥昔单抗(Thomas DA. J Clin Oncol, 2010, 28: 3880-3889)。
3.CODOX-M/IVAC(Magrath I. J Clin Oncol, 1996, 14: 925-934)。
(二) Ph--ALL 的治疗
1.诱导治疗:
(1) 治疗原则:
年龄 <40 岁的患者:临床试验或多药联合化疗(优先选择儿童特点方案)。
年龄 ≥40 岁的患者:
① <60 岁者,可以入组临床试验,或采用多药联合化疗;
② ≥60 岁者,可以入组临床试验,或采用多药化疗(不强调门冬酰胺酶的应用),或糖皮质激素诱导治疗。
临床试验:如常规的、前瞻性系统治疗方案;CD20 阳性的 ALL 患者可以采用化疗联合抗 CD20 的单克隆抗体治疗方案;其他有科学依据的探索性研究方案等。
(2) 具体治疗方案组合:
一般以 4 周方案为基础。至少应予长春新碱(VCR)或长春地辛、蒽环/蒽醌类药物[如柔红霉素(DNR)、去甲氧柔红霉素(IDA)、阿霉素、米托蒽醌等]、糖皮质激素(如泼尼松、地塞米松等)为基础的方案(VDP)诱导治疗。推荐采用 VDP方案联合 CTX 和左旋门冬酰胺酶(L-Asp)或培门冬酶组成的 VDCLP 方案,鼓励开展临床研究。
也可以采用 Hyper-CVAD 方案。
(3) 诱导治疗中注意事项:
① 蒽环/蒽醌类药物:可以连续应用(连续 2~3 d,第 1、3 周,或仅第 1 周用药);也可以每周用药 1 次。用药参考剂量:DNR 30~45 mg·m-2·d-1×2~3 d,IDA 6~10 mg· m-2·d-1×2~3 d,米托蒽醌 6~10 mg·m-2·d-1×2~3 d (如果为 2 mg/支,剂量调整为 6~8 mg·m-2·d-1)。
② 单次应用 CTX 剂量较大时(超过 1 g )可予以美司钠解救。
③ 诱导治疗第 14 天复查骨髓,根据骨髓情况调整第 3 周的治疗。诱导治疗第 28(±7)天判断疗效,未能达 CR 的患者进入挽救治疗。
④ 尽早开始腰椎穿刺、鞘内注射,预防 CNSL (可选择在血细胞计数达安全水平时进行)。
2.CR 后的治疗:
为减少复发、提高生存率,诱导治疗结束后应尽快开始缓解后的巩固强化治疗(诱导缓解治疗和缓解后治疗不要有过长的间歇期)。应根据患者的危险度分组情况判断是否需要行 allo-HSCT ,需行 allo-HSCT 者积极寻找供者。
(1) 治疗原则:
年龄 <40 岁的患者:
①继续多药联合化疗(尤其是 MRD 阴性者);
② allo-HSCT(尤其是 MRD 阳性、高白细胞计数或伴预后不良细胞遗传学异常的 B-ALL,T-ALL 患者)。
年龄 ≥40 岁的患者:
① <60 岁者,继续多药联合化疗(尤其是 MRD 阴性者);或考虑 allo-HSCT (尤其是 MRD 阳性、高白细胞计数或伴预后不良细胞遗传学异常的 B-ALL, T-ALL 患者)。
② ≥60 岁或不适合强烈治疗者(高龄、体能状态较差、严重脏器并发症等)可考虑继续化疗。
(2) 具体注意事项:
缓解后强烈的巩固治疗可清除残存的白血病细胞、提高疗效,但是巩固治疗方案在不同的研究组、不同的人群并不相同。一般应给予多疗程的治疗,药物组合包括诱导治疗使用的药物(如长春碱类药物、蒽环类药物、糖皮质激素等)、HD-MTX、Ara-C、6-巯嘌呤(6-MP)、门冬酰胺酶等。
因此,缓解后治疗可以有 1~2 个疗程再诱导方案,2~4 个疗程 HD-MTX、Ara-C、L-Asp 的方案。
在整个治疗过程中应强调参考儿童 ALL 方案的设计,强调非骨髓抑制性药物(包括糖皮质激素、长春碱类、L-Asp)的应用。
① 一般应含有 HD-MTX 方案。MTX 1~3 g/m2 ( T-ALL 可以用到 5 g/m2 )。应用 HD-MTX 时应争取进行血清 MTX 浓度监测,注意甲酰四氢叶酸钙的解救,至血清 MTX 浓度 <0.1 µmol/L(或低于 0.25 µmol/L )时结合临床情况可停止解救。
② 应含有 Ara-C 为基础的方案。Ara-C 可以为标准剂量、分段应用(如 CTX、Ara-C、6-MP 为基础的方案),或中大剂量 Ara-C 为基础的方案。
③ 可以继续应用含 L-Asp 的方案(大肠杆菌或欧文氏菌来源,或培门冬酶)。
④ 缓解后 6 个月左右参考诱导治疗方案给予再诱导强化 1 次。
⑤ 干细胞移植的问题:考虑 allo-HSCT 的患者应在一定的巩固强化治疗后尽快移植。无合适供者的高危组患者(尤其是 MRD 持续阴性者)、标危组患者( MRD 阴性者)可以考虑在充分的巩固强化治疗后进行 AHSCT 。AHSCT 后的患者应继续给予一定的维持治疗。
无移植条件的患者、持续属于低危组的患者按计划巩固强化治疗。
3.维持治疗:
ALL 患者强调维持治疗,维持治疗的基本方案:6-MP 60~75 mg/m2 每日 1次,MTX 15~ 20 mg/m2 每周 1 次。
注意:
① 6-MP 晚上用药效果较好。可以用硫鸟嘌呤(6-TG)替代 6-MP 。维持治疗期间应注意监测血常规和肝功能,调整用药剂量。
② ALL 的维持治疗既可以在完成巩固强化治疗之后单独连续进行,也可与强化巩固方案交替序贯进行。
③ 自获得 CR 后总的治疗周期至少 2 年。
维持治疗期间应尽量保证每 3~6 个月复查 1 次。
推荐方案:
1.中国成人急性淋巴细胞白血病协作组(CALLG)——CALLG-2008 治疗方案。
2.CALGB8811 方案(Larson RA. Blood, 1995, 85: 2025-2037)。
3.BFM 强化方案(Stock W. Blood, 2008, 112:1646-1654)。
4.Hyper-CVAD方案(MDACC)(Kantarjian H. Cancer, 2004, 101: 2788-801)。
5.MRC UKALLXII/ECOG E2993(Rowe JM. Blood, 2005, 106: 3760-3767)。
6.DFCI Pediatric ALL Consortium regimen(DeAngelo DJ. Leukemia, 2015, 29: 526-534)。
7.ALL IC-BFM 2002(Star J. J Clin Oncol, 2013, 32:174-184)。
(三) Ph+-ALL 的治疗
1.非老年( <60 岁) Ph+-ALL 的治疗:
(1) 诱导缓解治疗:
① 临床试验;
② 多药化疗+酪氨酸激酶抑制剂(TKI)治疗。
诱导治疗和一般 Ph--ALL 一样,建议给予 VCR 或长春地辛、蒽环/蒽醌类药物、糖皮质激素为基础的方案(VDP)诱导治疗;鼓励进行临床研究。
一旦融合基因(PCR方法)或染色体核型/FISH 证实为 Ph/BCR-ABL 阳性 ALL 则进入 Ph+-ALL 治疗序列,可以不再应用 L-Asp 。自确诊之日起即可以加用(或酌情于第 8 或 15 天开始) TKI ,推荐用药剂量:伊马替尼 400~600 mg/d、达沙替尼 100~140 mg/d ;优先推荐 TKI 持续应用。
若粒细胞缺乏[尤其是中性粒细胞绝对计数(ANC)<0.2×10^9/L]持续时间较长(超过 1 周)、出现感染发热等并发症时,可以临时停用 TKI ,以减少患者的风险。
诱导治疗第 14 天复查骨髓,根据骨髓情况调整第 3 周的治疗。诱导治疗第28(±7) 天判断疗效,同时复查骨髓和细胞遗传学(诊断时有异常者)、BCRABL融合基因,判断疗效。有 allo-HSCT 条件者,行 HLA 配型,寻找供者。
尽早开始腰椎穿刺、鞘内注射,预防 CNS L(可选择在血细胞计数达安全水平时进行)。
(2) CR 后的治疗:
Ph+-ALL 的缓解后治疗原则上参考 Ph--ALL ,但可以不再使用 L-Asp 。TKI 优先推荐持续应用,至维持治疗结束(无条件应用 TKI 的患者按一般 ALL 的治疗方案进行)。
① 有合适供者的患者可以选择 allo-HSCT ,移植后可以用 TKI 维持。
② 无合适供者的患者,按计划继续多药化疗联合 TKI 。
③ 无合适供者、BCR-ABL 融合基因转阴性者(尤其是 3~6 个月内转阴性者),可以考虑 AHSCT ,移植后予 TKI 维持。
④ 应定期监测 BCR-ABL 融合基因水平,CNSL 的预防治疗参考一般 ALL 患者。
(3) 维持治疗:
① 可以应用 TKI 治疗者,用 TKI 为基础的维持治疗(可以联合 VCR 、糖皮质激素或 6-MP、MTX ;或联合干扰素),至 CR 后至少 2 年。
② 不能坚持 TKI 治疗者,采用干扰素维持治疗,300 万U/次,隔日 1 次[可以联合 VCR 、糖皮质激素,和(或)6-MP、MTX ],缓解后至少治疗 2 年。或参考 Ph--ALL 进行维持治疗。
维持治疗期间应尽量保证每 3~6 个月复查 1 次骨髓象、融合基因(BCR-ABL)定量和(或)流式细胞术 MRD 。
2.老年Ph+-ALL( ≥60 岁)的治疗:
老年 Ph+-ALL 的治疗原则上参考老年 Ph--ALL ,同时联合 TKI 。TKI 优先推荐持续应用,至维持治疗结束。
(1)诱导缓解治疗:
① 临床试验;
② TKI +糖皮质激素;
③ TKI +多药化疗。
(2) CR 后的治疗:
继续 TKI +糖皮质激素,或 TKI +化疗巩固。之后参考非老年患者的维持治疗方案进行维持治疗。
推荐方案:
1.GMALL 06//99和07/03方案(Wassmann B. Blood, 2006, 108:1469-1477)。
2.Hyper-CVAD方案联合伊马替尼或达沙替尼(Thomas DA. Blood, 2004,103: 4396-4407; Ravandi F. Blood, 2010, 116:2070-2077)(MDACC)。
3.Northern Italy Leukemia Group Protocol 09/00(Bassan R. J Clin Oncol,2010,28 :3644-3652)。
4.JALSG ALL202(Yanada M. Br J Haematol, 2008,143: 503-510)。
5.GIMEMA LAL0201-B(Vignetti M. Blood, 2007, 109:367)。
三、MRD的监测
(一) MRD 监测的时机
ALL 整个治疗期间应强调规范的 MRD 监测,并根据 MRD 监测结果进行危险度和治疗调整。
1.早期监测:
诱导治疗期间(第 14 天)和(或)结束时(第 28 天左右)。
2.缓解后定期监测:
应保证治疗第 16、22 周左右的 MRD 监测。
早期的 MRD 检测主要用于预后的判断。缓解后 MRD 水平高的患者具有较高的复发危险,应进行较强的缓解后治疗,以改善长期疗效。
(二)MRD的监测方法
1.经典的 MRD 检测技术:
① IG-TCR 的定量 PCR 检测( DNA 水平);
② 4~6 色的流式细胞术 MRD 检测;
③ 融合基因转录本的实时定量 PCR (如 BCRABL )。
2.新的高通量 MRD 检测技术:
① 基于 EuroFlow 的 ≥8 色的二代流式细胞术 MRD 检测;
② IG-TCR 的高通量测序。
(三) Ph+-ALL 疾病反复时应注意进行 ABL 激酶突变的分析。
四、CNSL 的诊断、预防和治疗
CNSL 是急性白血病(尤其是 ALL )复发的主要根源之一,严重影响白血病的疗效。诊断时有 CNS 症状者应先进行 CT 或 MRI ,排除出血或占位病变后再考虑腰椎穿刺,无 CNS 症状者按计划进行 CNSL 的预防。
(一) CNS 状态分类
CNS-1:白细胞分类无原始淋巴细胞(不考虑脑脊液白细胞计数)。
CNS-2:脑脊液白细胞计数 <5 个/μl,可见原始淋巴细胞。
CNS-3:脑脊液白细胞计数 ≥5 个/μl,可见原始淋巴细胞。
(二) CNSL 诊断标准
目前 CNSL 尚无统一诊断标准。1985 年在罗马讨论关于 ALL 预后差的危险因素时提出下列 CNSL 诊断标准:
脑脊液白细胞计数 ≥0.005×10^9/L ( 5 个/μl),离心标本证明细胞为原始细胞者,即可诊断 CNSL 。
流式细胞术检测脑脊液在 CNSL 中的诊断意义尚无一致意见,但出现阳性应按 CNSL 对待。
(三) CNSL 的预防
任何类型的成人 ALL 均应强调 CNSL 的早期预防。预防措施可以包括:
① 鞘内化疗;
② 放疗;
③ 大剂量全身化疗;
④ 多种措施联合。
1.鞘内化疗:
诱导治疗过程中没有 CNS 症状者可以在血细胞计数达安全水平
( PLT≥50×10^9/L ) 后行腰椎穿刺、鞘内注射。
鞘内注射主要用药包括地塞米松、MTX、Ara-C。常用剂量为 MTX 10~15 mg/次或 MTX+Ara-C ( 30~50 mg/次)+地塞米松三联(或两联)用药。
巩固强化治疗中也应进行积极的 CNSL 预防,主要是腰椎穿刺、鞘内注射(一般应 6 次以上,高危组患者可 12 次以上),鞘内注射频率一般每周不超过 2 次。
2.预防性头颅放疗:
18 岁以上的高危组患者或 35 岁以上的患者可进行预防性头颅放疗,放疗一般在缓解后的巩固化疗期或维持治疗时进行。预防性照射部位为单纯头颅,总剂量 1800~2000 cGy,分次完成。
(四) CNSL 的治疗
确诊 CNSL 的患者,尤其是症状和体征较明显者,建议先行腰椎穿刺、鞘内注射:MTX(10~15 mg/次)+Ara-C (30~50 mg/次)+地塞米松三联(或两联),每周 2 次,直至脑脊液正常;以后每周 1 次,共 4~6 周。
也可以在鞘内注射化疗药物至脑脊液白细胞计数正常、症状体征好转后再行放疗(头颅+脊髓)。建议头颅放疗剂量 2000~2400 cGy、脊髓放疗剂量 1800~2000 cGy,分次完成。进行过预防性头颅放疗的患者原则上不进行二次放疗。
五、难治复发 ALL 的治疗
(一) Ph--ALL
难治复发 Ph--ALL 的治疗目前无统一意见,可以选择的方案如下:
1.临床试验。
2.强化的 Hyper-CVAD 方案。
3.含 Ara-C 的方案。
4.CD20 阳性患者可以联合抗 CD20 的单克隆抗体治疗。
5.烷化剂联合方案。
6.T-ALL 可以采用奈拉宾(Nelarabine)治疗。
(二) Ph+-ALL
1.临床试验。
2.规律应用 TKI 为基础的治疗复发或不缓解的患者,以 ABL 激酶突变结果、前期用药为依据更换 TKI (如达沙替尼、尼洛替尼等)。
3.TKI 联合的化疗方案调整(选择以前未应用的化疗方案)。
4.TKI 耐药的患者可以采用治疗复发难治 Ph--ALL 的方案。
无论是 Ph--ALL ,还是 Ph+-ALL ,在挽救治疗的同时即应考虑 allo-HSCT 的问题并开始寻找供者,取得 CR 后尽快行 allo-HSCT 。
六、ALL 治疗反应的定义
(一) 骨髓和外周血疗效标准
1.CR :
① 外周血无原始细胞,无髓外白血病;
② 骨髓三系造血恢复,原始细胞 <5% ;
③ 外周血 ANC > 1.0×10^9/L;
④ 外周血 PLT > 100×10^9/L;
⑤ 4 周内无复发。
2.CR 伴血细胞不完全恢复(CRi):
PLT < 100× 10^9/L和(或) ANC < 1.0×10^9/L。其他应满足 CR 的标准。总反应率(ORR) = CR+CRi 。
3.难治性疾病:
诱导治疗结束未能取得 CR 。
4.疾病进展(PD):
外周血或骨髓原始细胞绝对数增加 25% ,或出现髓外疾病。
5.疾病复发:
已取得 CR 的患者外周血或骨髓又出现原始细胞(比例 >5% ),或出现髓外疾病。
(二) CNS 疾病的治疗反应
1.CNS 缓解:
CNS-2 或 CNS-3 患者取得 CNS-1 状态。
2.CNS 复发:
出现 CNS-3 状态或 CNSL 的临床症状(如面神经麻痹、脑/眼受累,或下丘脑综合征表现)。
(三) 纵隔疾病的治疗反应
纵隔疾病的疗效判断依赖胸部 CT 和 PET CT 。
CR:CT 检查纵隔肿大完全消失或 PET 阴性。
部分缓解:肿大的纵隔最大垂直直径的乘积(SPD)缩小 50% 以上。
PD:SPD 增加 25% 以上。
未缓解:不满足部分缓解或 PD 。
复发:取得 CR 的患者又出现纵隔肿大。
|
|