|
|
小屋自习室
发表于 2019-11-22 11:50:57
来自: 中国北京
复发难治性急性髓系白血病中国诊疗指南( 2017 年版)
一、复发、难治性急性髓系白血病(AML)诊断标准
1.复发性 AML 诊断标准:
完全缓解(CR)后外周血再次出现白血病细胞或骨髓中原始细胞 > 0.050 (除外巩固化疗后骨髓再生等其他原因)或髓外出现白血病细胞浸润。
2.难治性 AML 诊断标准:
经过标准方案治疗 2 个疗程无效的初治病例;CR 后经过巩固强化治疗,12 个月内复发者;12 个月后复发但经过常规化疗无效者;2 次或多次复发者;髓外白血病持续存在者。
二、复发、难治性 AML 治疗策略
总体而言,复发、难治性 AML 使用目前治疗方案的预后仍较差。难治性 AML 形成的主要原因是白血病细胞对化疗药物产生耐药。白血病细胞耐药分为原发耐药(化疗前即存在)和继发耐药(反复化疗诱导白血病细胞对化疗药物产生耐药)。
难治性白血病的治疗原则包括:
① 使用无交叉耐药的新药组成联合化疗方案;
② 中、大剂量的阿糖胞苷(Ara-C)组成的联合方案;
③ 造血干细胞移植(HSCT);
④ 使用耐药逆转剂;
⑤ 新的靶向治疗药物、生物治疗等。
对于复发的年轻 AML 患者(年龄 ≤ 60 岁),欧洲白血病网(ELN)推出根据患者年龄、缓解至复发的时间、细胞遗传学以及是否接受过 HSCT 进行预后评估,可供临床参考(表 1 )。
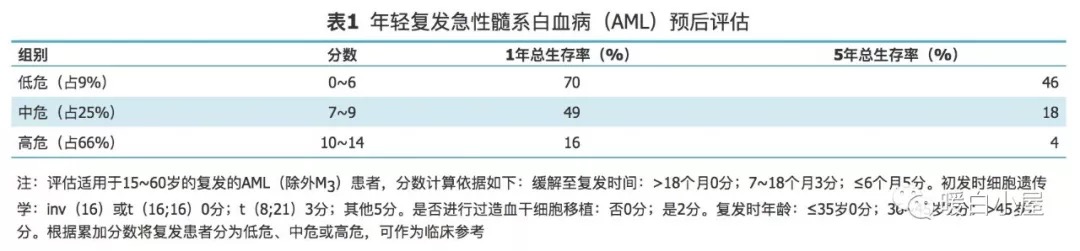
三、复发、难治性 AML 治疗选择
在化疗方案选择时,应综合考虑患者细胞遗传学、免疫表型改变、复发时间、患者个体因素(如年龄、体能状况、合并症、早期治疗方案)等因素,以及患者的治疗意愿。另外,建议完善分子表达谱的检测(包括 FLT3 突变)以帮助患者选择合适的临床试验。
1.复发患者的治疗选择要按照年龄来分层:
(1)年龄 <60 岁:
早期复发者( ≤ 12 个月)建议
① 临床试验(强烈推荐);
② 挽救化疗,继之 HLA 配型相合同胞或无关供者或单倍体 HSCT ,具体参考中国 HSCT 专家共识。
晚期复发者( > 12 个月)建议
① 临床试验(强烈推荐);
② 挽救化疗,继之相合同胞或无关供者、单倍体 HSCT ,具体参考中国 HSCT专家共识;
③ 重复初始有效的诱导化疗方案(如达到再次缓解,考虑进行异基因 HSCT )。
(2)年龄 ≥ 60 岁:
早期复发者建议
① 临床试验(强烈推荐);
② 最佳支持治疗;
③ 挽救化疗,体能状况佳者继之相合同胞或无关供者 HSCT ,具体参考中国HSCT专家共识。
晚期复发者建议
① 临床试验(强烈推荐);
② 重复初始有效的诱导化疗方案;
③ 挽救化疗,继之相合同胞或无关供者 HSCT ,具体参考中国 HSCT 专家共识;
④ 最佳支持治疗(用于不能耐受或不愿意进一步强烈治疗的患者)。
2.常见的复发难治化疗方案:
分为强烈化疗方案和非强烈化疗方案,强烈化疗方案以包含嘌呤类似物(如氟达拉滨、克拉屈滨)的方案为主,这些方案在很多临床试验中的缓解率达30%~45% ,中位生存期 8~9 个月。
(1)一般情况好、耐受性好的患者可选择以下强烈化疗方案:
① CLAG±M/I 方案:克拉屈滨 5 mg/m2 ,第 1~5 天;Ara-C 1~2 g/m2 ,第1~5 天,静脉滴注 3 h;G-CSF 300 μg/m2,第 0~5 天;加或不加米托蒽醌(Mitox)10 mg/m2 ,第1~3 天[或去甲氧柔红霉素(IDA)10~12 mg/m2 ,第1~3 天]。
② 大剂量 Ara-C (如果既往未使用过)加或不加蒽环类药物:Ara-C 1~3 g/m2,每 12 h 1 次,第 1、3、5、7 天;柔红霉素(DNR)45 mg/m2 或 IDA 10 mg/m2,第 2、4、6 天或 Mitox 或依托泊苷(Vp16)。或 Ara-C 3 g/m2 ,每 12 h 1 次,第 1~6 天。
③ FLAG 方案加或不加 IDA 。FLAG 方案:氟达拉滨(Flu)30 mg/m2,第 1~5 天;Ara-C 1~2 g/m2,Flu 用后 4 h 使用,第 1~5 天,静脉滴注 3 h ;G-CSF 300 μg/m2 ,第 0~5 天。
④ MEA 或 EA 方案:Mitox 10 mg/m2,第 1~5 天;Vp16 100 mg/m2,第 1~5天;Ara-C 100~150 mg/m2,第 1~7 天。
⑤ CAG 预激方案:G-CSF 150 μg/m2,每 12 h 1 次,第 0~14 天;阿克拉霉素(Acla)20 mg/d,第 1~4 天;Ara-C 20 mg/m2,分 2 次皮下注射,第 1~14 天。
⑥ HAA(或 HAD )方案:高三尖杉酯碱(HHT)2 mg/m2,第 1~7 天(或HHT 2 mg/m2,每日 2 次,第 1~3 天);Ara-C 100~200 mg/m2,第 1~7 天;Acla20 mg/d,第 1~7 天(或 DNR 40 mg/m2,第 1~7 天)。
(2)对于耐受较差的患者,可选择以下非强烈化疗方案:
① 低剂量 Ara-C:Ara-C 10 mg/m2,皮下注射,每 12 h 1 次,第 1~14 天。
② 去甲基化药物(地西他滨、阿扎胞苷):地西他滨 20 mg/m2,第 1~5 天,28 d 为 1 个周期,直至患者出现疾病恶化或严重不良反应。阿扎胞苷 75 mg/m2,第 1~7 天,28 d 为 1 个周期,直至患者出现疾病恶化或严重不良反应。
③ 对于伴 FLT3 突变的患者可采用去甲基化药物(阿扎胞苷或地西他滨)联合索拉菲尼治疗。
(3)HSCT:HSCT 可作为复发、难治白血病患者 CR2 后的挽救治疗,具体参考中国 HSCT 专家共识。
(4)Ⅲ 期临床研究药物:目前已发表的应用于复发、难治性 AML 的 Ⅲ 期临床研究药物主要包括 laromustine、clofarabine、elacytarabine、vosaroxin 等,其治疗价值有待进一步的研究结果说明。
|
|